Il reste moins d’un an aux entreprises du médicament pour adapter leur Supply Chain à la nouvelle règlementation DSCSA (Drug Supply Chain Security Act). L’enjeu est immense : pouvoir continuer à vendre leurs médicaments prescrits sur ordonnance aux Etats-Unis.
Selon l’OMS, un médicament sur 10 dans le monde serait une contrefaçon. Pour limiter la vente de contrefaçons, la FDA (Food and Drug Administration) a mis en place la loi DSCSA qui a pour but d’assurer la sécurité de la chaine d’approvisionnement en médicaments aux Etats-Unis.
Cette loi a été promulguée en 2013 et s’est petit à petit construite et précisée sur ses exigences. Le 27 novembre 2023 au plus tard, tous les fabricants, grossistes, distributeurs, reconditionneurs et prestataires logistiques tiers (3PL) devront être conformes à la loi s’ils veulent continuer à commercer avec les Etats-Unis.
L’objectif de la loi est clairement énoncé par la FDA : « créer un système électronique interopérable pour identifier et retracer certains médicaments sur ordonnance au fur et à mesure de leur distribution aux États-Unis ». [1]
Concrètement, qu’est-ce qui va changer pour l’industrie pharmaceutique ?
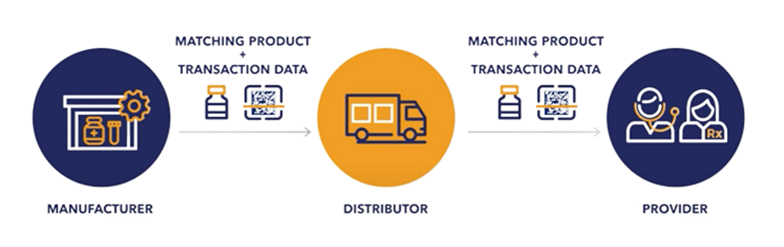
Tout d’abord en matière d’identification, la loi exige une sérialisation complète des produits par l’obligation d’avoir, sur l’emballage de chaque médicament sur ordonnance, un identificateur de produit (IP) unique, tel qu'un code barre. Cet emballage devra inclure le Code national des médicaments (NDC), le numéro de lot, le numéro de série et la date d’expiration en plus des informations actuellement demandées. Auparavant, les médicaments sur ordonnance n'étaient pas sérialisés jusqu'au niveau du produit individuel.
En ce qui concerne le suivi des produits, l'ensemble des acteurs devra obligatoirement utiliser des moyens électroniques, interopérables et sécurisés pour fournir les informations de transactions et relevés de transactions à leurs partenaires commerciaux. Concernant la vérification des produits, les différents acteurs devront disposer de systèmes leur permettant de se conformer aux exigences de vérification relatives à l'identification et au traitement des produits suspects et illicites. Enfin, tous les acteurs devront obligatoirement être reconnus en tant que partenaires commerciaux autorisés (Authorized Trading Partners - ATP) par la FDA ou le gouvernement pour accéder à la chaîne d'approvisionnement pharmaceutique américaine.
Où en sont les laboratoires pharmaceutiques fabricants ?
Selon la dernière enquête publiée par la HDA Research Foundation [2], l'industrie pharmaceutique et ses partenaires commerciaux ont fait "quelques progrès" dans la mise en œuvre des systèmes nécessaires pour se conformer à la loi. L'enquête révèle tout de même que 25 % des fabricants ne seront pas en mesure d’envoyer 100 % des données sérialisées requises par la DSCSA avec les produits expédiés d'ici au 27 novembre 2023.
Quelles actions pour être conforme au DSCSA en novembre 2023 ?
Il est donc l’heure de passer à l’action. Première étape : réaliser une analyse des écarts vis-à-vis de la réglementation et répartir les actions par priorité dans une feuille de route. Seconde étape : rechercher des axes d’optimisation au travers des processus étendus aux partenaires (3PL), outils (WMS) et nouvelles technologies (RFID) à implémenter, pour répondre au mieux aux nouvelles exigences de cette loi.
Sources :
[1] https://rfxcel.com/fr/dscsa-summary/
[2] https://www.hda.org/publications/2022-serialization-readiness-survey/